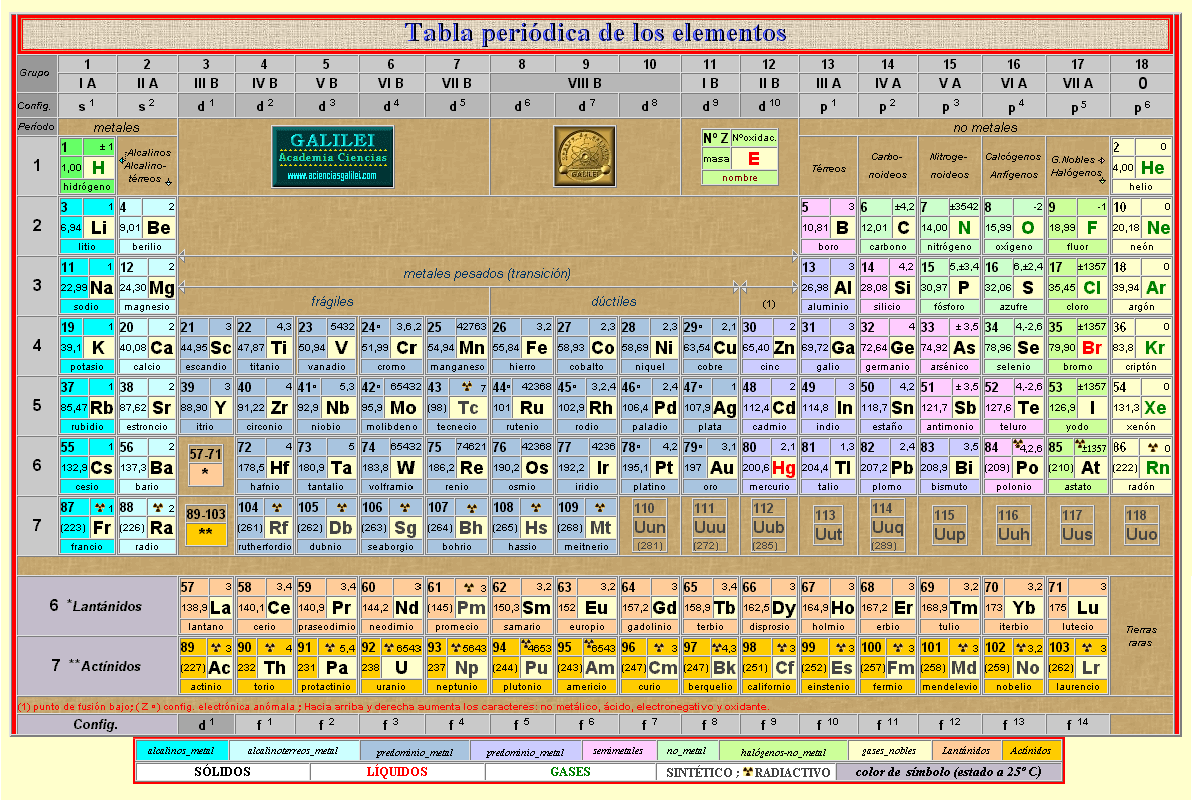
TABLA PERIÓDICA DE LOS ELEMENTOS QUIMICOS

¿QUE ES LA TABLA PERIODICA DE LOS ELEMENTOS?
La tabla periódica de los elementos clasifica, organiza y distribuye los distintos elementos químicos, conforme a sus propiedades y características.
Suele atribuirse la tabla a Dmitri Mendeléyev, quien ordenó los elementos basándose en la variación manual de las propiedades químicas, si bien Julius Lothar Meyer, trabajando por separado, llevó a cabo un ordenamiento a partir de las propiedades físicas de los átomos. La forma actual es una versión modificada de la de Mendeléyev, fue diseñada por Alfred Werner.
Descubrimiento de los elementos.
Aunque algunos elementos como el oro (Au), plata (Ag), cobre (Cu), plomo (Pb) y el mercurio (Hg) ya eran conocidos desde la antigüedad, el primer descubrimiento científico de un elemento ocurrió en el siglo XVII cuando el alquimista Henning Brand descubrió el fósforo (P). En el siglo XVIII se conocieron numerosos nuevos elementos, los más importantes de los cuales fueron los gases, con el desarrollo de la química neumática: oxígeno (O), hidrógeno (H) y nitrógeno (N). También se consolidó en esos años la nueva concepción de elemento, que condujo a Antoine Lavoisier a escribir su famosa lista de sustancias simples, donde aparecían 33 elementos. A principios del siglo XIX, la aplicación de la pila eléctrica al estudio de fenómenos químicos condujo al descubrimiento de nuevos elementos, como los metales alcalinos y alcalino–térreos, sobre todo gracias a los trabajos de Humphry Davy. En 1830 ya se conocían 55 elementos. Posteriormente, a mediados del siglo XIX, con la invención del espectroscopio, se descubrieron nuevos elementos, muchos de ellos nombrados por el color de sus líneas espectrales características: cesio (Cs, del latín caesĭus, azul), talio (Tl, de tallo, por su color verde), rubidio (Rb, rojo), etc.
Tríadas de Döbereiner.
Uno de los primeros intentos para agrupar los elementos de propiedades análogas y relacionarlo con los pesos atómicos se debe al químico alemán Johann Wolfgang Döbereiner (1780–1849) quien en 1817 puso de manifiesto el notable parecido que existía entre las propiedades de ciertos grupos de tres elementos, con una variación gradual del primero al último. Posteriormente (1827) señaló la existencia de otros grupos de tres elementos en los que se daba la misma relación (cloro, bromo y yodo; azufre, selenio y telurio; litio, sodio y potasio).
A estos grupos de tres elementos se les denominó tríadas y hacia 1850 ya se habían encontrado unas 20, lo que indicaba una cierta regularidad entre los elementos químicos.
Chancourtois.
En 1864, Chancourtois construyó una hélice de papel, en la que estaban ordenados por pesos atómicos (masa atómica) los elementos conocidos, arrollada sobre un cilindro vertical. Se encontraba que los puntos correspondientes estaban separados unas 16 unidades. Los elementos similares estaban prácticamente sobre la misma generatriz, lo que indicaba una cierta periodicidad, pero su diagrama pareció muy complicado y recibió poca atención.
Tabla periódica de Mendeléyev.
En 1869, el ruso Dmitri Ivánovich Mendeléyev publicó su primera Tabla Periódica en Alemania. Un año después lo hizo Julius Lothar Meyer, que basó su clasificación periódica en la periodicidad de los volúmenes atómicos en función de la masa atómica de los elementos.
Por ésta fecha ya eran conocidos 63 elementos de los 90 que existen en la naturaleza.
Grupos.
Numerados de izquierda a derecha utilizando números arábigos, según la última recomendación de la IUPAC (según la antigua propuesta de la IUPAC) de 1988, los grupos de la tabla periódica son:
Grupo 1 (I A): los metales alcalinos.
Grupo 2 (II A): los metales alcalinotérreos.
Grupo 3 (III B): Familia del Escandio.
Grupo 4 (IV B): Familia del Titanio.
Grupo 5 (V B): Familia del Vanadio.
Grupo 6 (VI B): Familia del Cromo.
Grupo 7 (VII B): Familia del Manganeso.
Grupo 8 (VIII B): Familia del Hierro.
Grupo 9 (VIII B): Familia del Cobalto.
Grupo 10 (VIII B): Familia del Níquel.
Grupo 11 (I B): Familia del Cobre.
Grupo 12 (II B): Familia del Zinc.
Grupo 13 (III A): los térreos.
Grupo 14 (IV A): los carbonoideos.
Grupo 15 (V A): los nitrogenoideos.
Grupo 16 (VI A): los calcógenos o anfígenos.
Grupo 17 (VII A): los halógenos.
Grupo 18 (VIII A): los gases nobles.
Períodos.
Las filas horizontales de la tabla periódica son llamadas períodos. Contrario a como ocurre en el caso de los grupos de la tabla periódica, los elementos que componen una misma fila tienen propiedades diferentes pero masas similares: todos los elementos de un período tienen el mismo número de orbitales. Siguiendo esa norma, cada elemento se coloca según su configuración electrónica. El primer período solo tiene dos miembros: hidrógeno y helio; ambos tienen sólo el orbital 1s.
La tabla periódica consta de 7 períodos:
Período 1
Período 2
Período 3
Período 4
Período 5
Período 6
Período 7
La tabla también está dividida en cuatro grupos, s, p, d, f, que están ubicados en el orden sdp, de izquierda a derecha, y f lantánidos y actínidos. Esto depende de la letra en terminación de los elementos de este grupo, según el principio de Aufbau.
Evolución de la tabla periódica de los elementos.

Tabla periódica actual, hecha por Mendeléyev, aunque con muchas modificaciones.
Tabla periódica de Mendeléyev.

Tabla periódica de John Dalton.

Tabla periódica por Robert Fludd.
Investigadores americanos, rusos y suizos han conseguido una vez más expandir la tabla periódica añadiendo dos elementos super-pesados, el 113 y el 115, en el Centro de Investigación Nuclear en Dubna (Rusia) empleando una combinación de técnicas físicas y químicas. El Instituto Paul Scherrer (PSI), con su experiencia radioquímica, ha sido crucial para el éxito del experimento.
Hasta 1940 el uranio era el elemento más pesado que se conocía. Desde entonces, se han descubierto más de veinte elementos con un número atómico mayor. Hace tiempo que se sospechaba la existencia de estos elementos ultra-pesados, aunque no ha sido hasta ahora cuando se ha dispuesto de la tecnología avanzada necesaria para realizar dichos experimentos. Quién sabe lo que se descubrirá a medida que los medios vayan evolucionando.
Confirman tres Nuevos Elementos en la Tabla Periódica.
Los científicos de la asamblea general de la Unión Internacional de Física Pura y Aplicada (IUPAP) confirmara los nombres y aprobara la incorporación definitiva de tres nuevos elementos.
Los elementos 110, 111 y 112 fueron confirmados bajo los nombres darmstadtio (Ds), roentgenio (Rg) y el copernicio (Cn). Cada uno tan pesado e inestable que sólo existe en laboratorio y rápidamente bajan a átomos más livianos.
“El nombramiento de estos elementos fue acordado tras consultar con físicos del mundo y estamos muy felices de verlos incluir en la tabla periódica”, comentó el doctor Robert Kirby-Harris, secretario general de la IUPAP y presidente de la IOP.
Los tres elementos fueron descubiertos por un equipo de la Compañía para la Investigación de Iones Pesados (GSI Helmholtz). El darmstadtio fue hallado en 1994 y recibió el nombre a partir de la ciudad alemana de Darmstadt, donde se ubica el GSI. El mismo año se descubrió el roentgenio, que obtuvo su nombre del físico alemán Wilhelm Conrad Roentgen (ganador del Premio Nobel y el primero en producir y detectar los rayos X en 1895). El copernicio fue logrado en 1996 luego de mezclar zinc y plomo, resultando en este pesado y radiactivo elemento. Su nombre se lo debe al astrónomo prusiano Nicolás Copérnico (el primero en sugerir que la Tierra gira en torno al sol).
El darmstadtium fue descubierto en 1994, en el Centro de Investigación de Iones Pesados, en Darmstadt (Alemania). No fue un descubrimiento convencional de algo que existe en la naturaleza sino que fue producido en laboratorio bombardeando un blanco de plomo 208 con iones de níquel 62. Se contaron cuatro átomos de este nuevo elemento químicos. Hasta 2001 no se reconoció oficialmente su existencia.

El Roentgenium fue descubierto el mismo año que el darmstadtium y en el mismo instituto alemán, pero los científicos en aquel momento sólo habían obtenido tres átomos y no se consideró suficiente para ser reconocido. Ocho años después se descubrieron otros tres átomos y se aceptó su existencia. Es uno de esos elementos que no existe en la naturaleza de forma natural, los científicos los crean mediante aceleradores de partículas para fusionar núcleos de otros elementos hasta conseguir los nuevos y se desintegran inmediatamente. Por ello, demostrar que se han producido resulta extremadamente complicado y se tardan años en lograr pruebas suficientes y convincentes.

El copernicium, también sintético, es extremadamente radiactivo.

 Se creó, en 1996, en el mismo instituto deDarmastadt, bombardeando núcleo de zinc-70 contra una blanco de plomo 208 en un acelerador de iones pesados, pero el resultado se consideró controvertido durante años y no fue reconocido como descubrimiento hasta su confirmación en 2009.
Se creó, en 1996, en el mismo instituto deDarmastadt, bombardeando núcleo de zinc-70 contra una blanco de plomo 208 en un acelerador de iones pesados, pero el resultado se consideró controvertido durante años y no fue reconocido como descubrimiento hasta su confirmación en 2009.
Ahora, los nuevos elementos químicos ya son oficiales, informa la Asamblea General de la IUPAP delegados de academias nacionales y sociedades de física de 60 países. En su última reunión, celebrada en Londres esta semana, además de bautizar oficialmente los tres nuevos elementos, se ha estrenado la primera mujer que ocupa el cargo de la institución: Celilia Jarlskog, de la Universidad Lund (Suecia).

OTRA NOVEDAD!!
A Mohammed Abubakr, ECE, GRIET, Hyderabad, India, se le ocurrió que se podía dibujar de una manera que sea mas interesante para los estudiantes y que además muestre algo de las propiedades de los elementos en forma gráfica.
pues aquí tenemos la TABLA PERIÓDICA CIRCULAR!
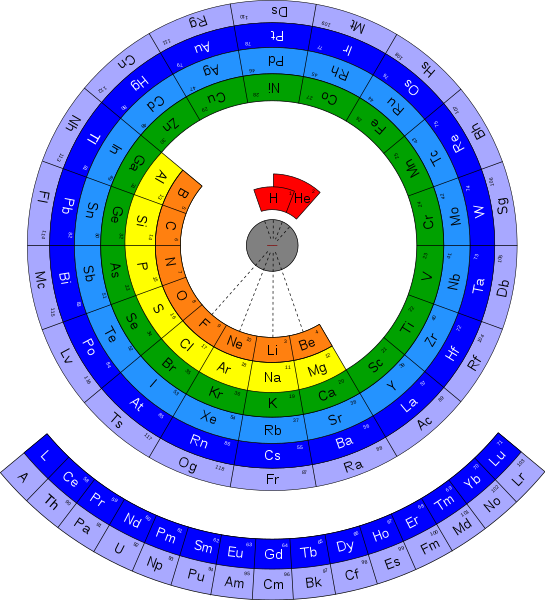
Lo puedes encontrar en la siguiente direccion: http://commons.wikimedia.org/wiki/File:Circular_form_of_periodic_table.svg

Petit Alo

Crea tu insignia